
단백질 구조 예측의 공로로 데미스 하사비스와 존 점퍼가 노벨 화학상을 수상한 지 얼마 지나지 않아, 그들의 연구를 집대성한 구글 딥마인드와 아이소모픽 랩스가 ‘알파폴드 3(AlphaFold 3, 이하 AF3)’를 공개했습니다. 이는 단순히 이전 버전의 성능을 개선한 것을 넘어, 생명 현상을 바라보는 패러다임 자체를 바꾸는 거대한 전환의 시작을 알리는 신호탄이었습니다. AF3는 단백질이라는 개별 부품의 설계도를 넘어, 세포라는 거대한 기계 속에서 단백질, DNA, RNA, 저분자 리간드, 이온 등이 함께 어우러져 작동하는 총체적인 상호작용의 지도를 그리겠다고 선언했습니다.
이러한 혁신적인 발표는 전 세계 연구자들에게 엄청난 기대감과 동시에 수많은 질문을 던졌습니다. AF3의 성능은 정말 광고하는 만큼 뛰어난가? 그 이면의 한계는 무엇인가? 논란이 된 라이선스 정책은 연구 현장에 어떤 영향을 미칠 것인가? 그리고 가장 중요하게, 한국의 연구자들은 이 거대한 기술적 파도를 어떻게 이해하고 활용해야 하는가?
이러한 궁금증에 답하기 위해, AF3의 공식 발표 내용을 심층 분석하고, 전 세계 연구자들이 내놓은 독립적인 검증 결과들을 종합하여 그 성능을 냉정하게 평가하고자 합니다. 나아가 라이선스 논쟁의 본질부터 실제 연구 현장에서 마주할 윤리적, 비용적 문제까지, 한국 연구자가 당장 점검하고 준비해야 할 7가지 핵심 포인트를 체계적으로 짚어볼 것입니다.
I. 기사 한눈에 보기: 발표 내용의 해부
AF3의 등장은 알파폴드 2(AF2)가 해결했던 ‘단백질 접힘 문제’의 지평을 근본적으로 확장한 사건입니다. AF2가 단일 단백질 사슬이나 단백질 복합체의 정적인 3차원 구조를 예측하는 데 집중했다면, AF3는 생명의 거의 모든 분자들이 참여하는 동적인 상호작용 네트워크 전체를 예측하는 것을 목표로 합니다. 이는 마치 자동차의 개별 부품 설계도를 확보하는 수준에서, 엔진과 변속기, 전자제어장치가 모두 맞물려 돌아가는 전체 시스템의 작동 원리도를 얻게 된 것에 비유할 수 있습니다.
이러한 도약의 핵심에는 완전히 새로운 아키텍처가 자리 잡고 있습니다. AF3는 AF2의 구조 모듈 대신, AI 이미지 생성기에 사용되는 것과 유사한 ‘확산 모델(diffusion model)’을 도입했습니다. 이 모델은 원자들이 무작위로 흩어져 있는 ‘원자 구름’ 상태에서 시작하여, 점진적으로 노이즈를 제거하고 위치를 재조정하며 가장 정확한 분자 구조로 수렴해 나가는 방식을 취합니다. 이 생성적 접근법 덕분에 단백질뿐만 아니라 다양한 형태와 크기의 분자들을 유연하게 다룰 수 있게 되었습니다. 또한 AF2의 ‘에보포머(Evoformer)’를 개선한 ‘페어포머(Pairformer)’ 모듈은 입력된 모든 분자 쌍 간의 관계를 처리하여 상호작용 예측의 정확도를 높이는 데 기여합니다.
이 새로운 아키텍처를 통해 AF3는 다룰 수 있는 ‘분자 언어’의 범위를 대폭 확장했습니다. 이제 단백질과 DNA, RNA 간의 상호작용은 물론, 신약 개발의 핵심인 저분자 화합물(리간드), 생체 내 금속 이온, 그리고 단백질의 기능을 켜고 끄는 스위치 역할을 하는 번역 후 변형(Post-Translational Modifications, PTMs)까지 모델링할 수 있게 되었습니다.
딥마인드는 공식 발표에서 기존 예측 방법에 비해 단백질과 다른 분자 유형 간의 상호작용 예측 정확도가 최소 50% 향상되었으며, 일부 중요한 상호작용 범주에서는 정확도가 두 배로 증가했다고 주장했습니다. 특히 PoseBusters 벤치마크에서는 물리 기반의 기존 도구들을 능가하는 성능을 보였다고 강조했습니다.
이러한 발표는 AF3가 단순한 ‘예측’ 도구를 넘어 ‘시뮬레이션’ 엔진으로 진화하고 있음을 시사합니다. 리간드의 유무에 따라 단백질의 구조 변화를 예측할 수 있다는 점은 , 정적인 최종 구조를 맞추는 것을 넘어 특정 조건에 따른 시스템의 ‘변화’를 모사하는, 원시적인 형태의 인 실리코(in silico) 실험에 가까워졌음을 의미합니다. 이는 구조생물학이 시스템생물학으로 나아가는 중요한 첫걸음입니다. 더불어, 이미지 생성 분야에서 성공을 거둔 확산 모델의 도입은 AI 분야 간 기술적 융합이 얼마나 빠르게 일어나고 있는지를 보여줍니다. 이는 생물학 AI의 미래가 일반 AI 연구의 발전 속도와 긴밀하게 연동될 것이며, 그 변화의 속도가 과거의 계산생물학과는 비교할 수 없을 정도로 빨라질 것임을 예고합니다.

II. 성능 팩트체크: 기대와 현실 사이
딥마인드의 화려한 발표 이후, 전 세계 연구자들은 독립적인 검증을 통해 AF3의 실제 성능을 파헤치기 시작했습니다. 수많은 사전 공개(preprint) 논문들을 통해 드러난 AF3의 성능은 빛과 그림자가 명확히 공존하는 모습입니다.
AF3가 뛰어난 성능을 보이는 영역
먼저 AF3가 약속을 지킨 부분부터 살펴보겠습니다. 독립적인 벤치마크 결과들은 AF3가 단백질과 리간드가 큰 구조 변화 없이 결합하는 ‘정적 복합체(static complexes)’ 예측에 매우 뛰어나다는 점을 일관되게 확인시켜 줍니다. 이러한 ‘자물쇠와 열쇠’ 모델의 경우, 기존의 도킹 프로그램보다 리간드 주변 아미노산 곁사슬(side-chain)의 방향을 더 정확하게 예측합니다.
이러한 강점 덕분에 AF3는 ‘검증된 상호작용의 구조 모델러(True-Hit Binary Interaction Modeler)’로서 강력한 가치를 지닙니다. 즉, 실험적으로 단백질 A와 리간드 B가 결합한다는 사실이 이미 알려진 경우, AF3는 그 둘의 결합 구조를 높은 품질의 3차원 모델로 생성해 줄 수 있습니다. 이는 신약 개발에서 약물의 작용 기전을 이해하고 추가적인 최적화 방향을 설정하는 데 매우 유용한 정보를 제공합니다.
또한, 치료용 항체 개발에 매우 중요한 항체-항원 결합 예측에서도 AF2-Multimer 버전에 비해 상당한 성능 향상을 보였습니다.
"Mind the Gap": AF3의 명백한 한계들
하지만 AF3는 만능이 아니며, 그 한계를 명확히 인지하는 것이 중요합니다. 연구자들이 발견한 주요 한계, 즉 ‘주의해야 할 격차(Mind the Gap)’ 목록은 다음과 같습니다.
첫째, ‘동적 복합체(dynamic complexes)’와 구조 변화(conformational change)에 매우 취약합니다. 단백질이 리간드와 결합하기 위해 스스로 구조를 바꾸는 ‘유도 적합(induced fit)’ 메커니즘을 제대로 예측하지 못합니다. 특히 단백질 구조 변화의 RMSD(Root Mean Square Deviation) 값이 5Å 이상인 경우 성능이 급격히 저하되는 것으로 나타나, 구조 유연성이 큰 단백질을 연구하는 경우 치명적인 약점이 될 수 있습니다.
둘째, 신약 개발에서 가장 중요한 ‘결합 친화도(binding affinity)’를 예측하지 못합니다. AF3가 제공하는 pLDDT나 ipTM 같은 신뢰도 점수는 예측된 구조가 얼마나 정확한지에 대한 정보일 뿐, 두 분자가 실제로 얼마나 강하게 결합하는지와는 거의 상관관계가 없는 것으로 밝혀졌습니다. 이는 AF3를 단독으로 사용하여 수많은 약물 후보물질들의 순위를 매기는 데에는 사용할 수 없음을 의미합니다.
셋째, ‘암기 대 일반화’ 문제, 즉 과적합(overfitting)의 징후를 보입니다. AF3의 훈련 데이터 마감일 이후에 공개된 새로운 단백질 구조에 대해서는 예측 성능이 눈에 띄게 감소하는 현상이 관찰되었습니다. 이는 AF3가 상호작용의 물리적 원리를 학습했다기보다는, 훈련 데이터인 단백질 데이터 뱅크(PDB)에 있는 구조들의 패턴을 ‘암기’했을 가능성을 시사합니다.
넷째, 특정 분자 계열에서 체계적인 오류를 보입니다. 주요 약물 타겟인 GPCR(G단백질 연결 수용체)의 경우, 활성제(agonist)가 결합하든 저해제(antagonist)가 결합하든 상관없이 지속적으로 ‘활성 상태’ 구조를 예측하는 편향을 보입니다. 치료제로 주목받는 D-펩타이드의 경우, 올바른 카이랄성(chirality) 예측률이 무작위 선택과 다를 바 없을 정도로 저조했습니다. 또한, 주요 기능으로 내세웠던 PTM 예측 역시 AF2에 비해 ‘미미한(modest)’ 개선에 그쳤으며, 대부분 변형이 없는 지배적인 구조를 예측하는 경향을 보였습니다.
마지막으로, 딥마인드가 비교 대상으로 삼았던 도킹 도구(Vina)가 최신 기술이 아니라는 비판도 제기되었습니다. 더 강력한 최신 도킹 프로그램을 사용하면 AF3의 ‘블라인드 도킹’ 성능을 능가할 수 있다는 연구 결과도 있습니다.
이러한 성능 프로파일은 AF3의 아키텍처와 훈련 데이터의 본질을 명확히 보여줍니다. AF3가 동적 복합체 예측에 실패하는 이유는 그것의 훈련 데이터인 PDB가 대부분 정적인 최종 상태의 결정 구조로 이루어져 있기 때문입니다. 즉, 모델은 상호작용의 ‘결과(what)’는 학습했지만, 그 ‘과정(how)’은 학습하지 못한 것입니다. GPCR 예측이 활성 상태로 편향되는 것 역시 연구자들이 주로 활성 상태 구조를 규명하여 PDB에 등록하기 때문으로, 모델이 훈련 데이터의 편향을 그대로 반영하고 있음을 보여줍니다. 이는 구조적 정확성과 생물학적 기능 사이의 간극이 여전히 넓다는 사실을 상기시킵니다. 아름다운 복합체 구조 그림을 얻는 것과 그것의 결합력이나 활성을 예측하는 것은 전혀 다른 차원의 문제입니다.
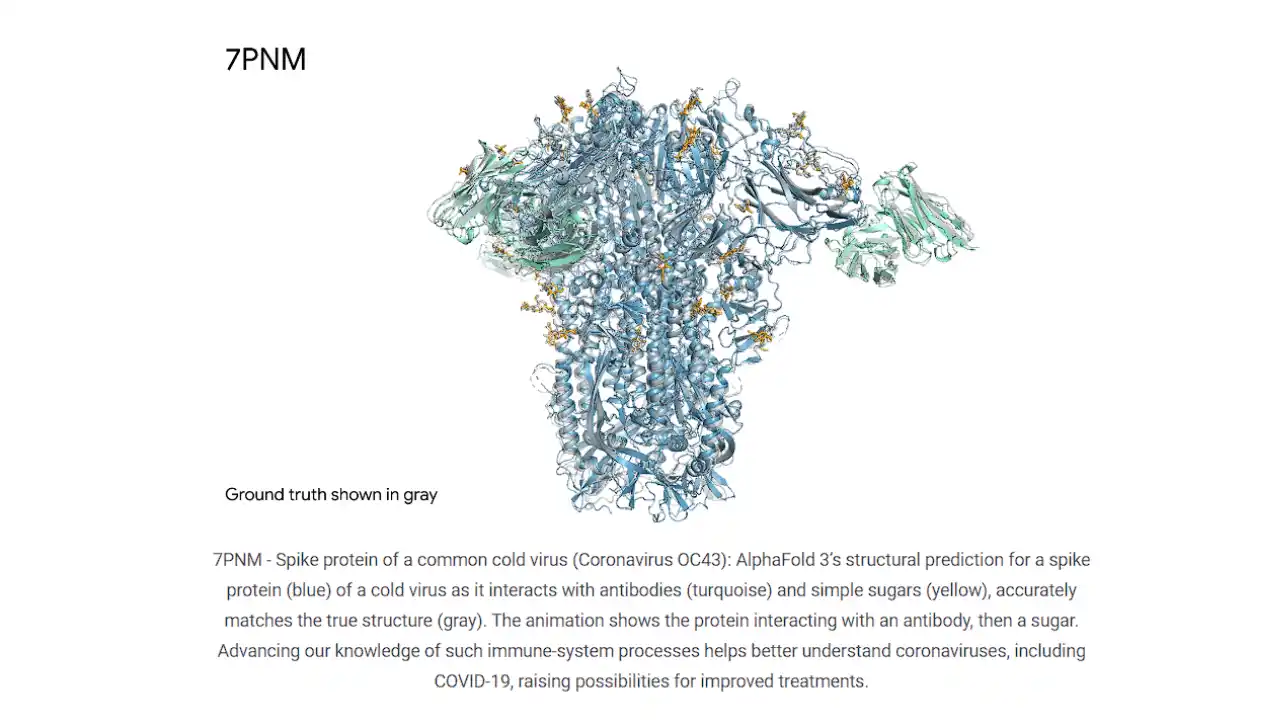
III. 오픈(or 프라이빗) 라이선스 논쟁
AF3의 출시는 기술적 논쟁만큼이나 뜨거운 라이선스 논쟁을 불러일으켰습니다. 이는 과학계의 오랜 가치인 ‘오픈 사이언스’와 거대 기술 기업의 상업적 이해가 정면으로 충돌한 사건이기 때문입니다.
AF2는 소스 코드와 데이터베이스가 비교적 자유롭게 공개되어 ColabFold와 같은 수많은 파생 도구와 거대한 연구 생태계를 탄생시켰습니다. 하지만 AF3는 훨씬 더 제한적인 접근 정책을 채택했습니다. 비상업적 연구자를 위한 ‘알파폴드 서버’는 무료이지만 사용량과 기능에 제약이 많은 웹 인터페이스 방식입니다. 소스 코드는 비상업적(Non-Commercial) 및 동일조건변경허락(ShareAlike) 조건이 붙은 CC-BY-NC-SA 4.0 라이선스로 공개되었습니다. 가장 핵심적인 ‘모델 가중치(weights)’, 즉 모델의 비밀 소스는 구글의 재량에 따라 별도의 신청을 통해서만 접근 가능하며, 상업적 사용을 명시적으로 금지하는 매우 엄격한 이용 약관이 적용됩니다.
이러한 폐쇄적 정책의 중심에는 구글의 모회사 알파벳이 설립한 ‘아이소모픽 랩스(Isomorphic Labs)’가 있습니다. 아이소모픽 랩스는 AF3의 상업적 활용을 독점하는 창구 역할을 하며, 이미 일라이 릴리(Eli Lilly), 노바티스(Novartis)와 같은 거대 제약사들과 총 30억 달러에 육박하는 대규모 파트너십을 체결했습니다. 이는 AF3의 막대한 상업적 가치를 명확히 보여줍니다.
이러한 행보에 과학계는 즉각 반발했습니다. 650명이 넘는 연구자들이 세계적인 과학 저널 Nature에 공개서한을 보내, 완전히 공개되지 않은 코드와 데이터를 기반으로 한 논문을 게재한 것은 저널 자체의 정책을 위반한 것이라고 비판했습니다. 이 사건은 AF3의 출시가 단순한 과학적 발표가 아니라, 치밀하게 계산된 비즈니스 전략의 일환임을 드러냅니다. 알파벳/구글은 AF2의 개방성을 통해 과학계의 신뢰와 지배력을 확보한 뒤(20,000회 이상의 인용이 이를 증명합니다 ), AF3에서는 ‘사다리 걷어차기’를 통해 본격적인 수익화에 나선 것입니다. 무료 서버와 비상업적 코드는 학계의 검증을 계속 유도하면서도, 실제 확장성 있는 기술력은 상업적 파트너에게만 제공하는 일종의 ‘프리미엄(Freemium)’ 모델입니다.
이러한 제한적 라이선스는 즉각적으로 AF3의 오픈소스 복제 모델 개발 경쟁을 촉발했습니다. Chai-1, Boltz와 같은 모델들은 상업적 활용이 가능한 아파치 2.0이나 MIT 라이선스를 채택하여, 기업 연구자들이 ‘변호사와 상의하지 않고도’ 사용할 수 있는 대안으로 떠오르고 있습니다. 이 논쟁은 과학계가 ‘오픈’의 진정한 의미를 재정의하도록 만들었습니다. 이제 단순한 코드 공개를 넘어, 상업적 활용이 가능한 라이선스 하에 ‘모델 가중치’까지 접근할 수 있어야 진정한 의미의 오픈소스라는 공감대가 형성되고 있습니다.

IV. 연구·산업 활용 체크리스트
AF3는 만능 해결사가 아니라, 더 나은 질문을 던지고 더 효율적인 실험을 설계하도록 돕는 ‘가설 생성기’입니다. 따라서 최적의 활용 전략은 기존의 실험적, 계산적 방법론과 결합한 하이브리드 파이프라인에 AF3를 통합하는 것입니다. 학계와 산업계 연구자들이 AF3를 현명하게 활용하기 위한 체크리스트는 다음과 같습니다.
학술 연구자를 위한 체크리스트
- DO: 새로운 단백질 복합체의 초기 구조 모델을 생성하여 저온전자현미경(cryo-EM)이나 교차결합(crosslinking) 실험의 가이드로 활용하십시오.
- DO: 돌연변이가 단백질 ‘구조’에 미치는 영향을 예측하여, 실험적으로 검증할 변이체의 우선순위를 정하는 데 사용하십시오. (단, 기능이나 안정성 변화 예측은 부정확함에 유의).
- DO: 관심 단백질의 잠재적 결합 부위를 예측하여 초기 화합물 스크리닝의 출발점으로 삼으십시오.
- CAUTION: 유연성이 매우 높거나 내재적 무질서 단백질(Intrinsically Disordered Protein, IDP) 영역(pLDDT < 50)에 대한 예측은 매우 신중하게 해석해야 합니다. AF3는 이러한 단백질의 다양한 구조 앙상블을 샘플링하도록 설계되지 않았습니다.
- DON'T: AF3의 신뢰도 점수를 리간드 결합 친화도 순위를 매기거나, 특정 돌연변이의 질병 유발 가능성을 판단하는 데 의존하지 마십시오. (후자의 경우 AlphaMissense가 더 적합한 도구입니다).
산업계(제약/바이오) 연구자를 위한 체크리스트
- DO: 대규모 가상탐색이나 신규 타겟 발굴을 위해서는 (파트너십을 통해) 아이소모픽 랩스를 이용하거나, 상업적 사용이 가능한 Chai-1, Boltz와 같은 오픈소스 대안을 활용하십시오.
- DO: 항체-항원 상호작용을 모델링하여 항체 공학 및 설계의 효율성을 높이십시오.
- DO: 화학단백질체학(chemoproteomics) 데이터에서 발굴된 ‘히트(hit)’ 화합물의 결합 구조를 모델링하여 작용 기전을 규명하는 데 활용하십시오.
- CAUTION: 무료 알파폴드 서버는 상업적 R&D에 절대 사용해서는 안 됩니다. 이는 명백한 이용 약관 위반입니다.
- DON'T: PROTAC과 같은 삼중 복합체나 큰 구조 변화를 동반하는 시스템의 예측 결과를 광범위한 실험적 검증 없이 신뢰하지 마십시오.
- DON'T: 리드 화합물 최적화(lead optimization)에 AF3를 단독으로 사용하지 마십시오. 예측된 구조는 반드시 물리 기반의 방법론으로 재평가(rescoring) 및 정제(refinement) 과정을 거쳐야 합니다.
이 체크리스트가 시사하는 바는 명확합니다. AF3의 가장 큰 가치는 실험의 ‘탐색 공간’을 획기적으로 줄여주는 데 있습니다. 수백만 개의 약물 후보군 중에서 가능성 높은 수천 개를 제시하거나, 수백 개의 돌연변이 중에서 구조적으로 가장 흥미로운 5개를 제안함으로써 실험의 사이클을 가속화하는 것입니다. 이는 동시에 생물학자에게 새로운 필수 역량으로 ‘AI 리터러시(AI literacy)’를 요구합니다. 이제 연구자들은 AI 모델의 예측 결과를 비판적으로 평가하고, pLDDT와 PAE 점수의 의미를 이해하며 , 언제 모델을 신뢰하고 언제 의심해야 하는지 판단할 수 있어야 합니다.
V. 계산 자원·비용 가이드
AF3를 활용하는 방법은 크게 세 가지로 나뉘며, 각각의 장단점과 비용 구조가 뚜렷합니다.
옵션 1: 무료 입문 - 알파폴드 서버
딥마인드가 직접 운영하는 웹 기반 포털로, 비상업적 목적에 한해 무료로 사용할 수 있습니다. 별도의 설치 없이 사용자 친화적인 인터페이스를 통해 AF3의 핵심 기능을 맛볼 수 있다는 장점이 있습니다. 하지만 상업적 사용이 불가능하고, 미리 정의된 일부 리간드 외에는 사용자가 원하는 분자를 입력할 수 없으며, 사용량이 몰릴 경우 대기 시간이 발생할 수 있습니다. 대규모 계산을 위한 API도 제공되지 않습니다.
옵션 2: 전문가 경로 - 로컬/HPC 설치
공개된 소스 코드를 자체 서버나 기관의 고성능 컴퓨팅(HPC) 클러스터에 직접 설치하여 사용하는 방식입니다. 이는 예측 과정에 대한 완전한 통제권을 가지며, 대규모 배치 작업이나 민감한 데이터를 다룰 수 있다는 장점이 있습니다. 그러나 상당한 계산 자원을 요구합니다. 모델 추론 단계에서는 80GB 이상의 메모리를 갖춘 NVIDIA A100/A800과 같은 최상급 GPU가 필수적이며 , 다중서열정렬(MSA)을 생성하는 데이터 파이프라인은 CPU 집약적입니다. 또한, AF3 구동에 필요한 데이터베이스의 크기가 2.2TB를 훌쩍 넘어 막대한 저장 공간이 필요합니다. 이러한 하드웨어 구축에만 수만 달러가 소요될 수 있으며, 유지보수 비용도 만만치 않습니다.
옵션 3: 유연한 대안 - 클라우드 컴퓨팅
구글 클라우드 버텍스 AI(Vertex AI)나 아마존 웹 서비스(AWS) 헬스오믹스(HealthOmics)와 같은 클라우드 플랫폼을 이용하는 방식입니다. 초기 하드웨어 투자 없이 사용한 만큼만 비용을 지불하는 유연성이 가장 큰 장점이며, 필요에 따라 수천 개의 GPU를 동시에 사용하는 등 대규모 확장이 가능합니다. 하지만 비용이 빠르게 누적될 수 있습니다. 가격 정책이 인스턴스 사용 시간, 저장 공간, API 호출 횟수 등 복잡한 변수로 구성되어 있어 예산 책정이 까다롭고, 복잡한 단일 구조 예측 하나에 수백 달러가 소요될 수 있어 대규모 스크리닝에는 상당한 예산이 필요합니다.
이러한 비용 구조는 계산생물학 분야의 ‘디지털 격차(digital divide)’를 심화시킬 수 있습니다. 풍부한 자원을 가진 연구 그룹이나 기업은 고가의 HPC 클러스터나 클라우드 예산을 확보하여 연구를 가속화하는 반면, 소규모 연구실이나 자원이 부족한 국가의 연구자들은 기능이 제한된 무료 서버에 의존할 수밖에 없는 불평등이 발생할 수 있습니다. 또한, 높은 고정 비용은 개별 연구실이 자체적으로 대규모 AF3 환경을 구축하고 유지하는 것을 비효율적으로 만들어, 결국 NIH의 Biowulf와 같은 기관 HPC 센터나 AWS, 구글 클라우드 같은 상업적 클라우드 제공업체에 대한 의존도를 높이는 결과를 낳습니다. 이는 대규모 컴퓨팅 인프라를 통제하는 소수 기관의 영향력을 더욱 강화시키는 요인이 됩니다.
VI. 윤리·보안 쟁점
AF3와 같은 강력한 기술의 등장은 필연적으로 윤리적, 안보적 질문을 수반합니다. 가장 첨예한 쟁점은 ‘이중용도(dual-use)’의 문제입니다. 이는 신약 개발과 같이 유익한 목적으로 설계된 기술이, 새로운 독소나 더 위험한 병원체를 설계하는 등 해로운 목적으로 악용될 수 있는 가능성을 의미합니다. AI 기반 단백질 설계 도구는 잠재적으로 악의를 가진 행위자들이 유해 물질을 설계하는 데 필요한 기술적 장벽을 낮출 수 있습니다.
이러한 위험에 대응하기 위해 다양한 완화 전략이 논의되고 있습니다. 딥마인드는 AF3의 제한적인 접근 정책이 이러한 잠재적 위험을 완화하기 위한 광범위한 평가의 결과라고 주장합니다. 한편, 과학계는 더 적극적인 자율 규제에 나섰습니다. 저명한 단백질 설계 연구자들이 주축이 된 ‘책임감 있는 바이오디자인 이니셔티브(Responsible Biodesign Initiative)’는 몇 가지 핵심 원칙을 제시했습니다. 여기에는 유익한 목적의 연구 수행, 소프트웨어의 보안 위험을 지속적으로 평가하는 ‘레드팀(red-teaming)’ 활동 , 그리고 가장 중요한 원칙으로, 유해 서열을 스크리닝하는 DNA 합성 업체만을 이용하겠다는 약속이 포함됩니다. 이 마지막 원칙은 디지털상의 설계가 물리적인 DNA로 합성되는 단계를 차단하는 가장 현실적이고 효과적인 ‘물리적 병목 지점(physical chokepoint)’으로 평가받습니다.
접근성의 윤리 문제 또한 중요합니다. 공공 데이터(PDB)를 기반으로 개발된 혁신 기술의 상업적 이익을 소수의 기업이 독점하는 것이 과연 윤리적으로 정당한가에 대한 근본적인 질문이 제기됩니다. 이러한 접근 제한은 부유한 국가에서 주로 발생하는 질병에 대한 치료제 개발은 가속화하는 반면, 개발도상국에 만연한 질병 연구는 뒤처지게 만드는 ‘의료 불평등’을 심화시킬 위험이 있습니다.
결국 이중용도 문제는 오픈 사이언스의 원칙과 근본적인 긴장 관계를 형성합니다. 과학 발전의 가속화를 위해 코드와 모델의 자유로운 공유를 주장하는 오픈 사이언스의 이상과, 잠재적 오용을 막기 위해 강력한 도구에 대한 접근을 제한해야 한다는 생물보안의 현실적 요구가 충돌하는 것입니다. AF3 사례는 이 복잡한 문제에 대한 정답이 없으며, 상업화 대 개방성을 넘어 안전 대 개방성이라는 새로운 차원의 논의가 필요함을 보여줍니다.
VII. 한국 연구생태계에 주는 시사점
AF3가 촉발한 거대한 변화의 물결 속에서 한국의 연구생태계는 어디에 위치하며, 어떤 전략을 취해야 할까요?
먼저, 한국은 단순히 기술의 소비자에 머물러 있지 않다는 점을 인식하는 것이 중요합니다. 갤럭스(Galux)와 같은 국내 기업들은 이미 세계적 수준의 단백질 설계 AI를 개발하여 경쟁력을 입증하고 있습니다. LG화학과 갤럭스의 항암 신약 공동 개발과 같은 사례는 국내 AI 기술을 산업적 성과로 연결하는 성공적인 모델을 제시합니다. 또한, KISTI(한국과학기술정보연구원)와 KOBIC(국가생명연구자원정보센터)과 같은 국가 슈퍼컴퓨팅 및 데이터 인프라는 AI-바이오 생태계의 필수적인 공공재 역할을 합니다. 특히 KOBIC이 ColabFold 서비스를 지원한 것은 연구자들의 접근성을 높인 구체적인 성공 사례입니다.
하지만 도전 과제도 명확합니다. 구글과 같은 거대 기업 모델에 대한 기술적 종속성은 장기적으로 국내 R&D의 독창성을 저해할 수 있습니다. 또한, 개별 연구실이나 기업이 구글의 계산 자원과 경쟁하는 것은 불가능하기에, 국가 차원의 공유 HPC 인프라(가칭 K-Bio HPC) 투자의 중요성은 아무리 강조해도 지나치지 않습니다.
이러한 상황에서 한국 연구생태계가 취해야 할 전략적 방향은 다음과 같습니다.
- 숙달 후 혁신 (Master, Then Innovate): AF3와 그 대안들을 적극적으로 활용하여 현재의 연구를 가속화하되, 본문에서 논의된 한계들을 명확히 인지하고 비판적으로 사용해야 합니다.
- 국가 인프라 적극 활용 (Leverage National Infrastructure): KISTI, KOBIC의 자원을 최대한 활용하고, 이들 공공 플랫폼에 AF3와 같은 최신 모델들이 신속하게 설치되고 안정적으로 운영되도록 지속적으로 요구하고 지원해야 합니다.
- 협력과 구축 (Collaborate and Build): LG-갤럭스 모델과 같은 산학연 협력을 더욱 활성화하여, AI 개발자, 생물학자, 임상의를 잇는 국내 자체의 개발-적용-검증 선순환 구조를 만들어야 합니다.
- 글로벌 오픈소스 생태계 기여 (Contribute to Global Open Source): 국내 AI 인재들이 Boltz와 같은 글로벌 오픈소스 프로젝트에 기여하거나 새로운 프로젝트를 시작하도록 장려해야 합니다. 이는 기술 전문성을 축적하고 특정 독점 기술에 대한 의존도를 낮추는 가장 효과적인 방법입니다.
궁극적으로 한국에 필요한 것은 단순히 외산 도구를 잘 사용하는 것을 넘어, ‘주권적인 AI-바이오 역량(sovereign AI-bio capability)’을 구축하는 것입니다. 이는 국내 자체 모델 개발(기술 주권)과 이를 누구나 활용할 수 있도록 지원하는 강력한 공공 HPC 인프라 구축(인프라 주권)이라는 두 가지 축으로 이루어져야 합니다. KISTI와 KOBIC의 역할 또한 단순한 데이터 저장소를 넘어 , 최신 AI 파이프라인, 전문가 컨설팅, 그리고 막대한 계산 자원을 제공하는 능동적인 ‘AI 구현 플랫폼(AI-enablement platform)’으로 진화해야 합니다. 이것이 국내 모든 연구자들에게 공평한 경쟁의 장을 마련해 줄 핵심 열쇠입니다.
VIII. 결론: 새로운 세계를 항해하는 법
알파폴드 3는 의심할 여지 없이 기념비적인 과학적 성취이자 혁명적인 도구입니다. 하지만 그것은 결코 전지전능한 신탁이 아닙니다. 강력하지만 명백한 한계를 지닌 도구이며, 이를 다루기 위해서는 사용자의 깊은 이해와 비판적 사고가 요구됩니다.
지금까지 살펴본 7가지 핵심 포인트를 다시 한번 정리하면 다음과 같습니다.
- 도약: AF3는 개별 단백질이 아닌, 생명 분자 전체가 참여하는 거대한 상호작용의 춤을 모델링합니다.
- 간극: 정적인 구조 예측은 신뢰할 수 있지만, 동적인 변화, 결합 친화도, 그리고 특수한 분자 계열에 대한 예측은 깊이 의심해야 합니다.
- 대가: ‘무료’ 접근에는 강력한 상업적 제약이 따르며, 이는 오픈 사이언스의 중대한 변곡점입니다.
- 전략: 실험실을 대체하는 것이 아니라, 더 나은 가설을 세우고 실험의 탐색 범위를 줄이는 데 활용해야 합니다.
- 비용: 진정한 성능을 끌어내기 위해서는 고가의 HPC 자원이 필수적이며, 이는 새로운 디지털 격차를 낳고 있습니다.
- 책임: 이중용도의 위험은 실재하며, 가장 효과적인 안전장치는 DNA 합성 단계의 스크리닝입니다.
- 한국의 길: 미래는 외산 도구의 단순 활용이 아닌, 국가 인프라를 기반으로 한 주권적 AI-바이오 생태계 구축에 달려 있습니다.
AI와 생물학은 이제 떼려야 뗄 수 없는 관계로 묶였습니다. 미래의 생명과학적 발견은 AI 혼자서도, 인간 혼자서도 이룰 수 없을 것입니다. 그것은 인간 과학자와 AI 파트너 간의 새로운 협력 관계를 통해 이루어질 것입니다. 이 새로운 세계에서의 성공은 AI의 강점을 이해하고, 약점을 보완하며, 인간의 독창성과 비판적 지성으로 AI를 현명하게 이끌어 나가는 이들의 몫이 될 것입니다. 혁명은 이미 시작되었고, 이제 우리의 과제는 그 거대한 파도를 지혜롭게 항해하는 것입니다.
참고자료
- Abramson, J., Adler, J., Dunger, J., et al. (2024). Accurate structure prediction of biomolecular interactions with AlphaFold 3. Nature.
- Jumper, J., Evans, R., Pritzel, A., et al. (2021). Highly accurate protein structure prediction with AlphaFold. Nature, 596, 583–589.
- Evans, R., O’Neill, M., Pritzel, A., et al. (2021). Protein complex prediction with AlphaFold-Multimer. bioRxiv.
- Zheng, H., Lin, H., Alade, A. A., et al. (2025). AlphaFold3 in Drug Discovery: A Comprehensive Assessment of Capabilities, Limitations, and Applications. bioRxiv.
- Baylink, A. (2025). AlphaFold 3 accurately models natural variants of Helicobacter pylori catalase KatA. bioRxiv.
- Childs, H., Zhou, P., & Donald, B. R. (2025). Has AlphaFold 3 Solved the Protein Folding Problem for D-Peptides? bioRxiv.
- Lin, H., et al. (2025). Assessing AlphaFold’s Ability to Model Conformational Changes Induced by Post-Translational Phosphorylation. bioRxiv.
- Yin, R., Feng, B. Y., et al. (2024). A comprehensive evaluation of AlphaFold3 for protein-peptide docking. bioRxiv.
- Henshall, W. (2024, May 8). Google DeepMind's Latest AI Model Is Poised to Revolutionize Drug Discovery. TIME.
- Claburn, T. (2024, May 9). DeepMind spinoff Isomorphic claims AlphaFold 3 predicts bio-matter down to the DNA. The Register.
- Kosinski, J. (2024). Improving AlphaFold 3 structural modeling by incorporating explicit crosslinks. bioRxiv.
- Isomorphic Labs. (2024, May 8). AlphaFold 3 predicts the structure and interactions of all of life’s molecules.
- Isomorphic Labs. (2024). Rational drug design with AlphaFold 3.
- Salt, H. (2024, May 9). Google DeepMind Unveils AlphaFold 3. Future Medicine AI.
- Stanly, M. (2024). Google DeepMind's AI model AlphaFold 3 can be a gamechanger in drug discovery. IndiaAI.
- Incorvaia, D. (2025, March 31). Alphabet's AI biotech Isomorphic Labs hauls in $600M to power next-gen drug design model. Fierce Biotech.
- A cautionary tale for open science: AlphaFold3. (2024, June 4). MR Online.
- Responsible AI x Biodesign. (2024). Commitments.
- 석차옥. (2024). 인공지능과 구조 기반 신약개발: 기회와 도전 과제. 국가생명공학정책연구센터 BioIn 리포트.
- 갤럭스(Galux). (2024). AI 신약개발 올림픽, 우리나라 성적은?. Press Release.
- 국가생명연구자원정보센터(KOBIC). (2023). 데이터와 공간. KOBICian's story.
- 서울대학교 생명과학부. (2023, March 9). 마틴 스타이네거 교수팀과 하버드대학 및 막스 플랑크 연구소의 공동 연구, 단백질 구조예측 플랫폼 ColabFold, 2022년 인공지능분야 최다 인용 논문 2위로 선정.
- Inductive Bio. (2024). A Strong Baseline for AlphaFold 3 Docking.
- Wei, G. W., et al. (2024). Independent Assessment of AlphaFold3. Journal of Chemical Information and Modeling.
- He, S., et al. (2024). AlphaFold3 versus experimental structures: assessment of the accuracy in ligand-bound G protein-coupled receptors. Acta Pharmacologica Sinica.
태그
#AlphaFold3 #알파폴드3 #구글딥마인드 #아이소모픽랩스 #단백질구조예측 #AI신약개발 #계산생물학 #구조생물학 #오픈사이언스 #라이선스 #생물정보학 #HPC #KOBIC #KISTI #이중용도 #바이오보안
'과학&IT' 카테고리의 다른 글
| 바이오테라(Bio-Tera) 프로젝트가 던진 숙제 ― 5조 개 단일세포 지도, 꿈인가 현실인가? (6) | 2025.06.29 |
|---|---|
| 손끝으로 느끼는 양자세계 — 연구진이 밝힌 ‘하이브리드 그래핀-큐빅 BN 비트’의 3대 돌파구 (3) | 2025.06.27 |
| 몸속에서 바로 ‘CAR-T 세포’를 만든다― 암·자가면역 질환 치료를 뒤흔들 ‘인바디 셀 엔지니어링’ 최신 전략 (9) | 2025.06.26 |
| ‘드래곤맨(龍人)’ 두개골이 던진 질문 ― 호모 롱기(Homo longi), 사피엔스의 가장 가까운 친척인가? (8) | 2025.06.25 |
| '8.4 m 거울 · 3.2 기가픽셀 눈' — 루빈 천문대 ‘올-스카이 망원경’이 바꿀 7가지 천문학 패러다임 (2) | 2025.06.24 |